邓宏魁教授的糖尿病干细胞治疗技术火了!申请此类发明专利有哪些“坑”?
![]()
干细胞(Stem Cells),被誉为“生命的种子”,因其自我更新能力和多向分化潜能,为治疗多种疾病提供了新的策略和可能性,例如血液病、组织修复和再生、神经退行性疾病、癌症、糖尿病、移植物抗宿主病等等,它的医学应用技术是现代医学的“圣杯”。
1956年,美国华盛顿大学的多纳尔·托马斯完成了世界上第一例骨髓移植手术,这标志着干细胞治疗的开始。1981年,英国剑桥大学的马丁·埃文斯率先从小鼠身上分离出胚胎干细胞。1998年,美国威斯康星大学的詹姆斯·汤姆森首次从人类胚胎中分离出胚胎干细胞(Embryonic Stem Cells,ES细胞),开启了干细胞研究的新纪元。
2006年,日本科学家山中伸弥通过基因工程技术从体细胞得到了诱导性多能干细胞(Induced Pluripotent Stem Cells ,iPSCs),直接颠覆了之前的成体细胞命运不能逆转的观点,获得2012年诺贝尔生理和医学奖。此后干细胞技术的产业转化开始加速,日本、美国、欧盟在相关专利申请和布局方面走在世界前列。
根据细胞来源,干细胞可以分为天然干细胞和人工干细胞,前者包括胚胎干细胞和成体干细胞,后者包括诱导多能干细胞(iPSC)和细胞核移植生成的干细胞。胚胎干细胞始终面临无法躲避的伦理问题,获取足够治疗用量的高纯度成体干细胞比较困难,细胞核移植技术的效率太低。而诱导多能干细胞(iPSC)因其避开了伦理问题、具有经济可行性、制备操作要求较低以及广泛的应用前景而受到医药产业界的青睐。
山中伸弥发明的“四因子法”诱导多能干细胞技术在面世之初惊艳了全世界,然而该技术依然在大规模临床应用方面存在一些重要缺陷,例如,逆转细胞命运的效率较低,操作较复杂,基因载体和外源基因导入细胞导致的致癌风险等等。
北京大学邓宏魁教授团队于2013年在《Science》杂志上发表了题为“Pluripotent stem cells induced from mouse somatic cells by small-molecule compounds”的论文,首次报道仅使用化学小分子将发育成熟的体细胞重编程到多能干细胞(chemically induced pluripotent stem cell, CiPSC),建立了细胞命运调控的化学重编程技术,开辟了全新的细胞命运调控途径。
CiPSC技术又经过10年磨砺,终于在最近传来了令人振奋的消息。来自南开大学附属医院、北京大学医学部的研究团队于今年9月25日在《细胞》杂志发表论文,公布了首例自体化学诱导多能干细胞(CiPSC)制备胰岛细胞移植治疗I型糖尿病临床研究的成果。目前接受治疗的患者病情已经持续稳定1年以上,实现了临床功能性治愈。该名25岁的患者在接受细胞移植之前,已经有10余年I型糖尿病病史,曾经接受过两次肝移植、一次胰腺移植,均告治疗失败。
经使用多种关键词和IPC分类号的组合进行检索,笔者发现目前化学诱导多能干细胞(CiPSC)制备技术的中国发明专利申请仅一百余项(2014年-2023年专利申请量数据见下图),已授权专利不足60项。从我国在该领域的核心技术专利数量来看,化学诱导多能干细胞(CiPSC)仍然是一个朝阳产业,未来可期。
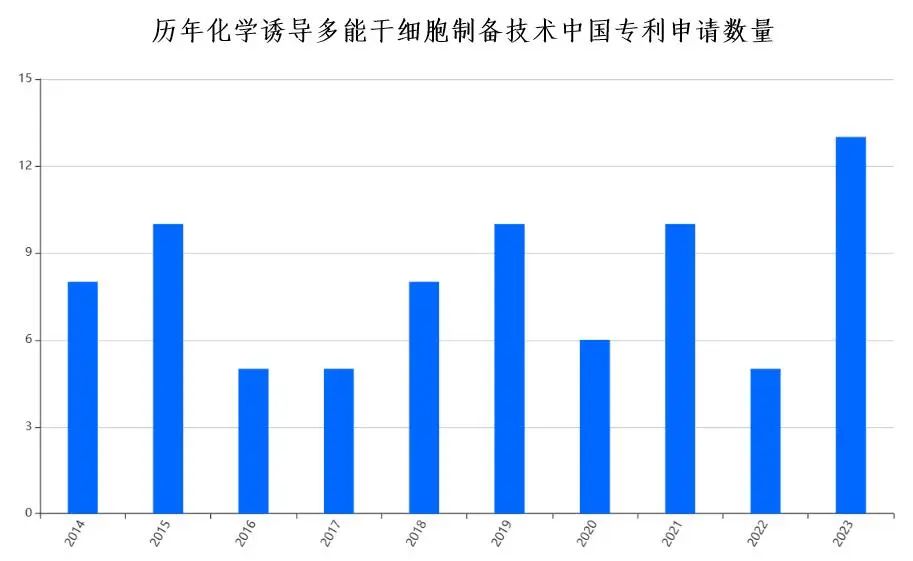
笔者根据近年来中国国家知识产权局针对化学诱导多能干细胞(CiPSC)制备技术专利申请的审查意见,总结了该技术领域中国专利申请的典型问题并加以分析,以期帮助相关企业、学术机构和科技行业从业者规避认识误区,缩短专利授权时间。

化学诱导体细胞重编程方法是CiPSC技术的核心。出于行业惯例,专利申请人通常会要求保护采用专利方法所制造的产品,而且为了要求尽可能宽的保护范围,申请人可能将非人类哺乳动物体细胞也纳入专利方法的应用对象。但是因生物技术的特殊性,此种产品权利要求在某些情形下可能得不到专利授权。
为方便讨论,我们先做如下技术性界定。诱导性多能干细胞可按照其分化潜能分为“全能性”诱导干细胞和“组织定向性”诱导干细胞。所谓“全能性”是指诱导性干细胞具有与胚胎干细胞相似的分化潜力,“组织定向性”是指某些诱导干细胞只能分化为属于某种组织的细胞类型,例如造血干细胞。
(一)属于《专利法》第25条第1款第(4)项所规定的不授予专利权的范围
为了使全能性CiPSC产品权利要求得到专利说明书的支持,申请人需要在说明书中记载多种针对全能性CiPSC的检测方法和结果,其中三胚层检测、畸胎瘤检测和嵌合体检测是本领域技术人员公认的检测方法,它们也是检测胚胎干细胞的公认方法,尤其是嵌合体检测,它还被认为是检测“全能性”的金标准。
专利审查员曾经在2021年的一份审查意见中指出,虽然(全能性)CiPSC并非胚胎干细胞,但根据说明书记载的三胚层检测、畸胎瘤检测和嵌合体检测的结果,其具有胚胎干细胞的生物学特性,可以将其理解为随着生物技术的发展而产生的生物学特性上的“胚胎干细胞”,其具有全能性,能够分化成为动物,因此其仍然属于“动物品种”的范畴。在另一份审查意见中,专利审查员进行了更详细的技术推理,即嵌合体动物可以通过同胞交配产生纯合子后代,并通过基因组标记进行识别,从而产生完全由干细胞发育而来的成体动物,因此以(全能性)CiPSC本身为技术主题的权利要求属于《专利法》第25条第1款第(4)项所规定的不授予专利权的范围。
(二)不符合《专利法》第22条第2款有关新颖性的规定
有些CiPSC制备技术通过干预出发细胞内特定信号通路状态的方式,获得具有组织定向分化潜力的“干性”细胞,例如表皮干细胞、呼吸道上皮干细胞等,其目的是将组织定向CiPSC用于制备临床级的特定组织细胞,因此并不需要将出发细胞重编程为“全能性”干细胞。
在正常人体组织内本就存在具有组织定向分化潜力的干细胞。经过数十年的研究,相当多的组织干细胞已经被分离、纯化、表征。表征天然组织干细胞的方式通常包括组织相关干性标志物的表达水平、组织特异性基因表达水平、在适宜条件下能被诱导分化成为属于特定组织类型的多种细胞系等。从科研角度看,组织定向CiPSC如果具有天然组织干细胞的上述表型,就可以被认为是一种具备组织定向干性和多能性的新型人工细胞,具备一定的科研价值和使用价值。但是从专利制度角度看,专利说明书中描述表征组织定向CiPSC实验结果的实施例,如未记载超出公知技术范围的细胞表型,则本领域技术人员就不能将其与天然组织干细胞进行区分,因此审查员可能认定组织定向CiPSC产品权利要求不符合《专利法》第22条第2款有关新颖性的规定。这种审查意见背后的逻辑与合成生物学方法生产的天然产物小分子(如香兰素)不能获得产品专利是一致的。

自从山中伸弥首次报道“四因子法”以来,全球的干细胞研究者展开了一场激烈的竞争,大家都在努力寻找各种能够逆转细胞命运的靶点及其组合,并发表了大量科研论文,申请了一批基础专利。究其底层策略,这些靶点主要在四个方面影响细胞重编程从而改变细胞命运,即细胞周期、能量代谢、表观遗传(染色质DNA甲基化和组蛋白修饰)以及细胞表面黏附分子。CiPSC技术建立在之前的科学研究的基础上,它也是通过影响上述四个方面的细胞生物行为来重编程,而选择能够影响不同靶点的小分子化合物的组合物就成为CiPSC制备技术的最关键部分。
早期的CiPSC制备技术专利为追求宽泛的保护范围,通常在独立权利要求中,以靶点为基础,采用上位概括的方式表述化学诱导剂组合物,例如MAPK抑制剂、组蛋白乙酰化剂、GSK3抑制剂等。
因细胞重编程底层策略的有限性,在后专利申请要求保护的诱导剂组合物,如果也以靶点抑制剂为技术特征,往往会因相对于在先申请专利的组合而丧失创造性。因此只能限缩权利要求的保护范围,以具体的化合物组合物为组成技术方案的技术特征。
但是目前这一修改方式也面临着新挑战。基于化合物文库的高通量筛选技术(参见Xi, C. , Yunkun, L. , Leyun, W. , Xiaojie, M. , Jiaqi, P. , & Lianyu, L. , et al. (2023). A fast chemical reprogramming system promotes cell identity transition through a diapause-like state. Nature cell biology(8), 25.)和以AlphaFold3为代表的人工智能技术极大的扩大了筛选范围,加快了新的重编程诱导剂组合物的发现。
面对上述挑战,专利申请人的应对策略除了扩大申请前的检索范围以避免诱导剂组合物丧失创造性之外,还可以通过限定诱导剂组合物的添加方式、浓度范围、培养时间等方式使独立权利要求符合《专利法》第22条第3款关于创造性的规定。

生物学属于实验科学,至今缺乏像理论物理学这样的基础理论;另外,因生物多样性,生物个体天然存在一定差异,难以通过严格的数学公式描述生物表型和行为特征。因此,从技术上而言,某个实验的结果难以在理论上当然的泛化,一种生物学技术的扩展应用需要得到实验结果的支持。
因CiPSC的制备技术颇耗资、耗时,研发人员为抢先申请专利,往往只在专利说明书实施例中提供少数的实验及其结果。在此种情形下,如果权利要求覆盖的范围超出了实验实施例记载的范围或权利要求未记载有关实验操作条件,则很可能被审查员认为权利要求得不到说明书的支持,不符合《专利法》第26条第4款的规定,例如,在以诱导剂组合物为主题的权利要求中只记载了组合物而没有记载各组分的浓度;在以诱导重编程方法为主题的权利要求中未记载诱导剂的浓度、培养时间或记载了超出实施例记载范围的出发细胞类型。
因《专利法》规定专利申请文件的修改不得超出原说明书和权利要求书记载的范围,笔者建议专利申请人在提交专利申请时,应当尽可能的完善实验,尽量提供包括不同实验条件的数据,这为以后按照审查意见修改权利要求提供更大的回旋余地,争取最宽的保护范围。

虽然我国2019年实施的新版《专利审查指南》不再采用一刀切的方式拒绝胚胎干细胞的可专利性,增加了一条例外条款,即,“如果发明创造是利用未经过体内发育的受精14天以内的人胚胎分离或者获取干细胞的,则不能以违反社会公德为理由拒绝授予专利权”,但是仍认定“人胚胎的工业或商业目的的应用”属于“违反社会公德”的情况。CiPSC因避免了胚胎干细胞(ES细胞)的伦理争议而受到广泛青睐,但这不意味着相关专利申请就没有伦理风险。
如前文所述,全能性CiPSC(包括来源于人的细胞)具有类似胚胎干细胞的特性,可以被植入胚泡在非人类替代亲本哺乳动物子宫内继续发育。一些类器官技术正是利用上述操作获得胎体的人源性器官组织。专利申请人可能将这种获得人源性类器官的技术方案与CiPSC制备技术方案并案申请,但是上述获取类器官的技术方案涉及破坏人体胎儿或利用人体胎儿组织,违背伦理,违反社会公德,属于专利法第5条第1款规定的不能被授予专利权的范围。另外,因此种类器官技术涉及将胚泡植入子宫的手术操作,属于外科手术方法,因此该方法无法在产业上使用,不具备《专利法》第22条第4款规定的实用性。

CiPSC产业应用方兴未艾,各种新技术层出不穷。在为CiPSC相关技术申请专利时,申请人或专利代理师应当密切注意科学技术的发展现状,始终把握生物技术特殊性在专利的新颖性、创造性和实用性方面造成的潜在障碍。另外,凡是涉及胚胎发育的技术主题均应关注其是否存在伦理风险。我们也看到技术进步显著推动法律变革的历史轨迹,相关人员应及时更新对法律法规变化以及专利审查意见倾向性的认知。
















 沪公网安备 31010602001694号
沪公网安备 31010602001694号