原研药企篇丨药品专利纠纷早期解决机制下企业如何应对
2021年7月4日,国家药监局、国家知识产权局联合发布关于《药品专利纠纷早期解决机制实施办法(试行)》(以下简称《早期解决办法》)的公告,配套法规《最高人民法院关于审理申请注册的药品相关的专利权纠纷民事案件适用法律若干问题的规定》、《药品专利纠纷早期解决机制行政裁决办法》几乎同时发布。
至此,中国的药品专利链接制度建设宣告完成。这一制度无论对原研药企还是仿制药企,都将产生深远的影响。原研药苦仿制药技术方案不透明、强仿上市,仿制药遇原研药专利泡沫刺破动力不足等问题,有望在早期予以解决。本文试以原研药企的视角逐一分析应对之策。
一、《早期解决办法》为原研药企由Bolar例外带来的困局提供破解法门
《专利法》第七十五条第一款第(五)项规定下的Bolar例外,即“为提供行政审批所需要的信息,制造、使用、进口专利药品或者专利医疗器械的,以及专门为其制造、进口专利药品或者专利医疗器械的”不视为侵犯专利权,曾给原研药企带来很大困扰。
例如,在石药集团恩必普药业有限公司诉丽珠集团利民制药厂侵害发明专利权纠纷案((2019)最高法民申2178号)中,原研药企恩必普公司就诉称一、二审法院不审查仿制药是否落入专利权的保护范围而简单适用Bolar例外作出不侵权判决,令专利权人维权无门。但最高人民法院认为,利民制药厂向药品评审中心申请注册仿制药,该行为在本质上系请求行政机关给予行政许可的行为,并不属于专利法第十一条第一款中规定的“实施专利”的行为,故不构成侵权。
而在山德士(中国)制药有限公司诉江苏豪森药业集团有限公司侵害发明专利权纠纷案((2019)闽01民初2796号)中,仿制药企豪森公司在原研药专利权尚未届满前,即开始参加药品集中采购活动,法院虽认定构成许诺销售且侵权成立,但由于无法证明在专利有效期内有实际销售行为,最后仅判决豪森公司赔偿山德士公司为制止侵权行为支出的合理费用15万元。
仿制药远在专利到期前就可申请注册,甚至在获得药品批文后抑制不住巨额市场利润的诱惑,进而强仿上市,专利权人却对此无能为力的尴尬局面,在《早期解决办法》施行后有望打破,如向法院申请禁令阻止仿制药在专利到期前上市销售。同时,刺破专利泡沫获得12个月市场独占期等潜在丰厚回报,也将充分调动仿制药企挑战专利的积极性。战场已备好,只等一方吹响号角。
二、原研药企如何与仿制药企博弈取胜?
1、基础工作,专利信息登记
根据《早期解决办法》第二条以及《化学药品注册分类及申报资料要求》对化学药品的注册分类,适用《早期解决办法》的条件如下:(1)原研药已在中国境内注册上市,即化学仿制药对应的是4类注册申请;(2)原研药的相关专利信息已在中国上市药品专利信息登记平台(网址https://zldj.cde.org.cn/home,以下简称“平台”)进行登记。
因此,第一步将原研药引入中国市场后,紧随而至的第二步工作就是尽快在平台上完成专利信息登记。
除化学药外,中药、生物制品的上市许可持有人也可进行相关专利信息登记。截至2021年9月1日,登记平台已共登记了787个原研药的专利信息,其中化学药524个(67%),如下图1所示。

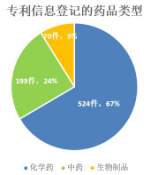
图1
以化学药为例,药品上市许可持有人在平台上需要登记的内容包括:主体信息、药品信息,专利信息(包括:活性成分化合物专利、含活性成分的药物组合物专利、医药用途专利,药品与相关专利权利要求的对应关系),如下图2-5中勃林格殷格翰为“马来酸阿法替尼片”登记的专利信息:


图2

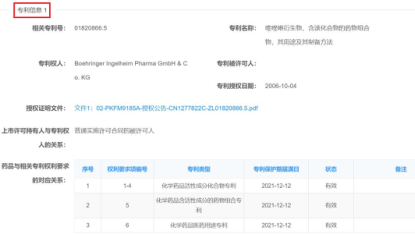
图3
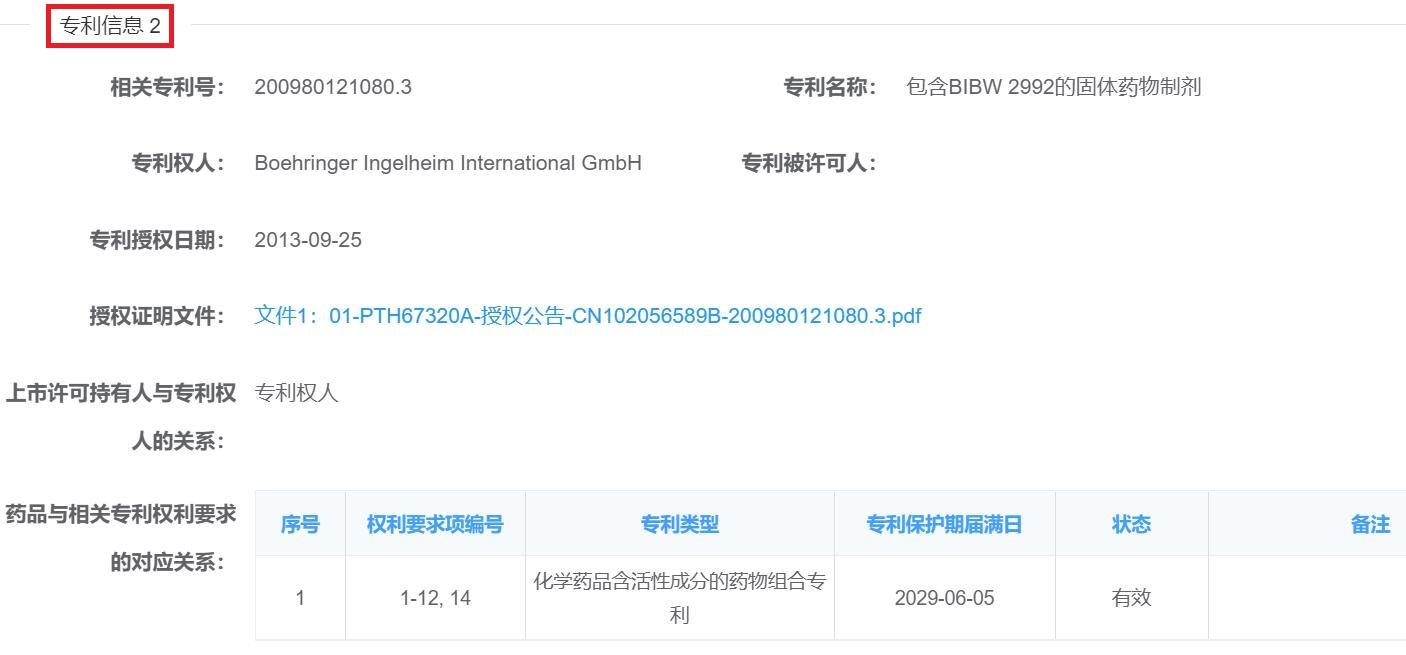

图4


图5
如何挑选拟在平台上登记的相关专利及其对应的权利要求,需要技术部门和法务部门共同应对,甚至外部律师的专业协助也不可或缺。
2、收到仿制药企的“请战书”后,原研药企如何应对?
(1)原研药企与仿制药企的博弈
一旦仿制药企发出四类声明“被仿制药相关专利权应当被宣告无效,或者其仿制药未落入相关专利权保护范围”[1],即宣告战斗打响,作战地图如下:


图6
由于版面原因,上图的流程只描述了原研药企(上市许可持有人)针对仿制药申请人的四类声明提起诉讼或申请行政裁决的情形。如仿制药企提交的是一、二、三类声明,或在四类声明下原研药企未起诉或申请裁决,则不启动9个月的等待期,CDE根据技术审评结论和专利声明种类,直接作出是否批准上市的决定。
如图6所示,对仿制药企来说,只要不是《早期实施办法》第九条第二款第(一)项所述结果,即“确认落入相关专利权保护范围的,待专利权期限届满前将相关化学仿制药注册申请转入行政审批环节”(提前获批上市落空),其他几种情形或与Bolar例外时期法律规定的结果持平,或优于该结果,尤其是成功拿到12个月的市场独占期。
对原研药企来说,则恰好相反。最坏的结果是专利权被宣告无效、维权基础荡然无存,仿制药蜂拥而至;其次是仿制药技术方案未落入专利权保护范围,获得批文并上市销售。最好的结果是迫使仿制药在专利权期限届满前再转行政审批环节,但仿制药企提前做好一致性评价等工作,以尽可能节省行政审批环节所耗时间,则影响几乎与《早期实施办法》施行前的专利悬崖情形相同。
(2)对于化学仿制药,触发12个月市场独占期的条件是:①首个挑战专利成功+②首个获批上市。
挑战专利成功,要求仿制药企提交四类声明,并根据其提出的宣告专利权无效请求,相关专利权被宣告无效,因而使仿制药获批上市。
根据上述标准,笔者经检索发现平台上目前登记的仿制药尚无可能获得市场独占期。其中,最接近的是南京正大天晴制药公司仿Daiichi Sankyo Europe GmbH(第一三共的欧洲子公司)的“甲苯磺酸艾多沙班片”,为“3+4.1”类专利声明,如下图7:

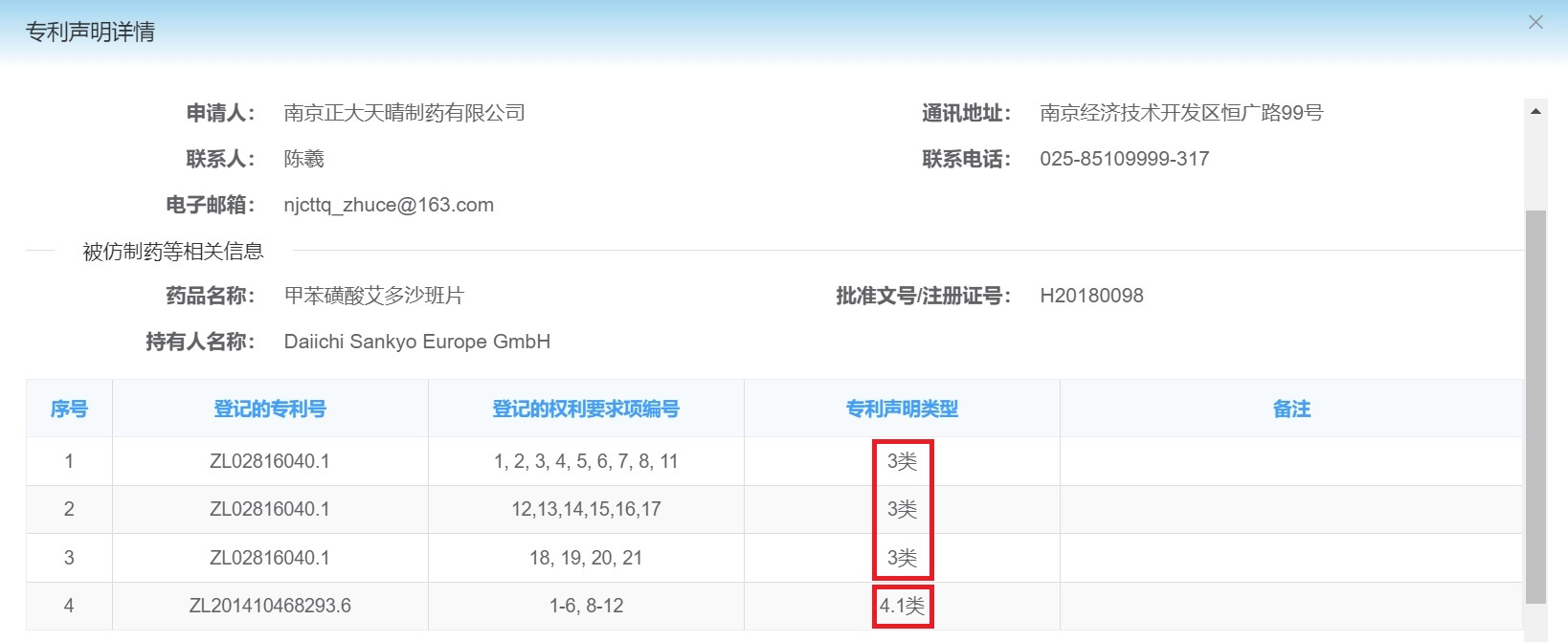
图7
即使4.1类声明对应的专利权全部被宣告无效,由于还存在3类声明对应的专利权,正大天晴也不符合“挑战专利成功”的条件。其他仿制药则仅提交了4.2类声明(如浙江华海药业股份有限公司仿“盐酸鲁拉西酮片”)或“3+4.2”类声明(如江苏豪森药业集团有限公司仿“达格列净片”),它们由于缺少专利权无效宣告环节,故离获得市场独占期的条件更远。
因此,针对仿制药企的专利声明类型,原研药企需要具体分析后分别作出应对之策。
(3)集中带量采购制度对原研药企应对策略的影响
《国务院办公厅关于推动药品集中带量采购工作常态化制度化开展的意见》(国办发〔2021〕2号)第二.(七)条规定“对通过一致性评价的仿制药、原研药和参比制剂不设置质量分组,直接以通用名为竞争单元开展集中带量采购,不得设置保护性或歧视性条款”,第五.(十四)条规定“对同通用名下的原研药、参比制剂、通过一致性评价的仿制药,实行同一医保支付标准”。
2021年1月29日,国家医疗保障局副局长陈金甫在关于该意见的国务院政策例行吹风会上答记者问时指出,“基本上是采取原研药加通过一致性评价的仿制药,只要达到三家就可以列入集采”[2]。即,满足“1(原研药)+2(仿制药)”可纳集采。
因此,对原研药企来说,如果第一家仿制药企(笔者注:指最有可能获得市场独占期的企业)还尚可成为朋友,则从第二家开始就是必须严阵以待的对手,否则很快就面临灵魂砍价的集采局面。
从这个层面上说,当专利纠纷的攻防形势需要原研药企作出取舍时,给第一家仿制药企的12个月市场独占期让路也未尝不可,以尽可能延缓原研药被纳入集采篮子的时间。
3、其他未登记专利或技术秘密也可成为利器
化学药除《早期实施办法》规定要求登记的三种专利(活性成分化合物专利、含活性成分的药物组合物专利、医药用途专利)外,还包括制备方法、制剂、中间体、晶型等专利,即使仿制药被批准上市,如认为其侵犯前述相应专利权的,原研药企仍可提起侵权之诉。
另外,技术秘密仍可能使原研药的质量更胜一筹,也经常是原研药在专利到期后保持市场热度的利器,企业需做好日常的技术秘密维护工作。
三、原研药企需予以关注的其他重要因素
1、专利有效期限的延长
专利法》第四十二条规定,发明专利授权以及新药上市审评审批过程中的不合理延迟,应专利权人的请求,可给予适当的专利权期限补偿。
因此,原研药企在专利申请和行政审批的流程管理中不应忽视这重要一环,做好日常的期限监控,以便在符合要求时及时提出期限补偿请求。
2、关注如数据保护等的立法动态
《药品管理法实施条例》第三十四条第二款规定,新型化学成份药品获得上市许可后具有6年的数据保护期。《关于鼓励药品医疗器械创新保护创新者权益的相关政策(征求意见稿)》则规定更加细致,除创新药外,还拟给予孤儿药、儿童专用药一定年限的数据保护期。一旦法规落地,对原研药企也是重大利好,作用不亚于专利的强保护。
因此,建议原研药企持续跟踪相关立法动态。
四、总结
在笔者看来,《早期解决办法》首先鼓励原研药企第一时间在中国上市创新药,丰富中国市场的药品可及性,同时,也给原研药企和仿制药企提供了专利纠纷早期解决的良好机制。在双方博弈过程中,原研药企的应对需考虑如下几个因素:
1、坚守专利无效阵地,专利维持有效是一切的根本,且在前期做好专利有效期限控管工作;
2、投入技术力量和法律支持,确保获得确认仿制药的技术方案落入专利权保护范围,迫使其行政审批与专利期限届满挂钩,尽可能延缓原研药专利悬崖期的到来;
3、综合判断后,适当选择与第一家仿制药企和解,甚至给第一家仿制药企的市场独占期让路;
4、重视原研药的技术秘密维护和数据保护。
参 考 文 献
[1] 仿制药企作出的专利声明分为如下四类:
一类声明:中国上市药品专利信息登记平台中没有被仿制药的相关专利信息;
二类声明:中国上市药品专利信息登记平台收录的被仿制药相关专利权已终止或者被宣告无效,或者仿制药申请人已获得专利权人相关专利实施许可;
三类声明:中国上市药品专利信息登记平台收录有被仿制药相关专利,仿制药申请人承诺在相应专利权有效期届满之前所申请的仿制药暂不上市;
四类声明:中国上市药品专利信息登记平台收录的被仿制药相关专利权应当被宣告无效(“4.1类声明”),或者其仿制药未落入相关专利权保护范围(“4.2类声明”)。
[2] 国务院政策例行吹风会.
















 沪公网安备 31010602001694号
沪公网安备 31010602001694号